ВЗЯТИЕ И ФИКСАЦИЯ МАТЕРИАЛА
(Г.А.Меркулов. Курс патологогистологической техники. — 1967.
Микроскопическая техника: Руководство / Под редакцией Д.С.Саркисова и Ю.Л.Перова. — М.: Медицина, 1996. ISBN 5-225-02-820-9).
Важнейшими условиями получения высококачественных гистологических препаратов являются:
1. возможно более раннее получение материала,
2. минимальное травмирование ткани,
3. адекватная фиксация.
ТЕХНИКА ВЫРЕЗКИ МАТЕРИАЛА
Оптимальная площадь кусочков ткани 2 — 3 см 2, толщина 5 — 7мм.
Вырезанные кусочки ткани непосредственно с лезвия ножа погружают в фиксатор. Недопустимы сдавливание кусочков, промывание их водой, а также очистка поверхности органа, особенно слизистой оболочки, инструментами, пальцами и т.д. После погружения кусочков в сосуд с фиксатором туда же опускают этикетку с номером (шифром, маркировкой), написанным карандашом или тушью на матовой поверхности фотобумаги. В тех случаях, когда возникает необходимость маркировки каждого кусочка, его вместе с этикеткой завязывают в марлевый мешочек. Возможно также нанизывание кусочков на нитку: сначала 2 — 3 раза прошивают этикетку первого кусочка, затем сам кусочек, потом следующую этикетку и так далее до 10-15 кусочков.
В Самарском ОБСМЭ проводится также маркировка кусочков органов на картонах с подписями несмываемыми чернилами, после подрезки кусочков маркированный картон укладывают в марлевый узелок вместе с подрезанным кусочком.
При наличии патологически измененных участков тканей и органов кусочки вырезают на границе с нормальной тканью.
Кусочки полых органов вырезают таким образом, чтобы в препарате были видны все слои стенки. Кусочки стенки полого органа удобно предварительно распластывать на фотобумаге или картоне.
Для изучения стенки сосуда на большом протяжении его разрезают вдоль, свертывают в виде рулона и прошивают посередине.
Для исследования рыхлой соединительной ткани готовят пленчатые препараты: после осторожной препаровки соединительнотканную пленку натягивают пинцетом на обезжиренное предметное стекло и фиксируют.
ОБЩИЕ ПРИНЦИПЫ ФИКСАЦИИ
Фиксация обеспечивает стабилизацию тканевых структур и их уплотнение. Механизм действия фиксаторов основан на коагуляции белков и стабилизации липидов.
Фиксация всегда приводит к большим или меньшим изменениям структуры и объема ткани, степень выраженности которых зависит от рН фиксатора, его концентрации, температуры, продолжительности воздействия и других факторов. Концентрация ионов водорода фиксатора должна соответствовать таковой в тканях, поэтому фиксатор должен иметь рН, близкий к нейтральному. Увеличение температуры фиксатора ускоряет процесс, но вызывает еще большие изменения в тканях. Слишком продолжительная фиксация приводит к значительному уплотнению материала, что в дальнейшем затрудняет его обработку. Для каждого конкретного вида исследования подбирают наиболее приемлемый фиксатор. Чем меньшую деформацию будут претерпевать тканевые структуры при фиксации, чем быстрее и глубже будет их действие на ткань, тем лучшей считается фиксирующая жидкость.
Полноценная фиксация материала обеспечивается при соблюдении ряда требований.
1. После вырезки кусочка ткани его немедленно погружают в фиксатор.
2. Объем фиксатора должен превышать объем фиксируемого материала в 10-20 раз, так как тканевая жидкость может существенно изменить концентрацию фиксатора.
3. В том случае, если цвет фиксатора изменяется после погружения в него кусочков ткани, фиксатор необходимо немедленно сменить.
4. Недопустимо повторное использование фиксаторов.
5. Для каждого фиксатора следует соблюдать установленное время фиксации. Длительное пребывание материала возможно лишь в некоторых фиксаторах, например 10 % нейтральном формалине, жидкости Буэна.
Для фиксации лучше использовать емкости с широким горлом, чтобы не возникло проблем с извлечением фиксированного материала. Равномерность фиксации некоторых рыхлых тканей, например легочной, достигается помещением их на дно банки, а поверх них — прокладки из слоя марли или ваты. Данный приём позволяет избежать дефекта фиксации кусочков лёгочной ткани в виде прилипания их к покрывающей банку перчаточной резине с последующем развитием аутолиза в кусочке. При большом количестве материала кусочки переслаивают ватой или марлей.
Чаще материал фиксируют при комнатной температуре, но для некоторых видов исследования (гистохимических, электронно-микроскопических и др.) необходимо проводить фиксацию при 4 °С. Материал срочных биопсий фиксируют при повышенной температуре фиксатора. При ускоренной фиксации в глубине объекта быстро развиваются аутолитические процессы.
ПРОСТЫЕ ФИКСИРУЮЩИЕ ЖИДКОСТИ
Формалин. Основным, широко применяемым фиксатором служит формалин, представляющий собой 40 % раствор формальдегида. Из него готовят нейтральный (забуференный до рН 7,0) 10-12 % формалин. Для этого в банку с 40% формалином засыпают карбонат кальция или магния либо смесь этих солей — доломит из расчета 100 г на 1 л формалина. Для получения 10 % нейтрального формалина через 24 ч к 1 части 40 % нейтрального формалина добавляют 9 частей водопроводной воды. Продолжительность фиксации 24-48 ч при 20 °С.
Универсальным фиксатором, пригодным для гистологических и большинства гистохимических исследований, является нейтральный формалин по Лилли.
A. 100 мл 40 % формалина + 900 мл дистиллированной воды.
Б. 4 г дигидроортофосфата натрия моногидрата (однозамещенного фосфата натрия).
B. 6,5 г гидроортофосфата натрия (двузамещенного фосфата натрия).
Если на дне банки с 40 % формалином образовался осадок белого цвета (параформальдегид), то его можно растворить, подогрев до 70-80 °С (в вытяжном шкафу!), и использовать для фиксации.
Этиловый спирт (80 %, 90 %, 96 % и 100 %). Его применяют в качестве фиксатора для выявления гликогена, железа, амилоида, но он растворяет липиды. Механизм действия основан на осаждении белков, при этом происходит обезвоживание объектов, что значительно ускоряет проводку. Продолжительность фиксации от 2 ч до 1 сут. Увеличение длительности фиксации, особенно в 100 % спирте, нежелательно, так как материал значительно уплотняется и происходит его пересушивание. Оптимальная температура для фиксации материала в спирте +4 °С, но ее можно проводить и при комнатной температуре. Если после спиртовой фиксации предстоит резать ткань на замораживающем микротоме или криостате, то кусочки промывают в течение 1-2 ч до их полного погружения на дно банки, при этом происходит насыщение ткани водой.
Ацетон (его действие подобно действию спирта). Ацетон используют для увеличения скорости фиксации.Применяют 100 % ацетон, для получения которого в коммерческий ацетон засыпают прокаленный сульфат меди (медный купорос) или силикагель. В ацетоне фиксируют кусочки толщиной 3-4 мм в течение 2 ч при 20 °С или 30 мин — 1 ч в термостате при 60 °С в плотно закрытой посуде. Ацетон значительно уплотняет ткань и при увеличении продолжительности фиксации возможно сморщивание объектов. Чаще ацетон применяют для обработки материала срочных биопсий при его заливке в парафин.
Сулема (дихлорид ртути). Сулему применяют в качестве фиксатора с начала развития гистологии. Готовят насыщенный раствор: 10 г сулемы на 100 мл дистиллированной воды или изотонического раствора хлорида натрия доводят до кипения, охлаждают, фильтруют. Продолжительность фиксации кусочков толщиной 3 мм 6-12 ч при 20 °С. При фиксации сулемой возможно появление в тканях кристаллического осадка, который удаляют путем обработки срезов йодированным 70 % спиртом (на 50 мл 70 % спирта — 5-10 капель 5 % спиртового раствора йода до появления оранжевого цвета). По мере обесцвечивания йодированного спирта со срезами его заменяют свежей порцией вплоть до полной потери цвета, затем срезы промывают в 3 — 4 сменах 70 % спирта.
СЛОЖНЫЕ ФИКСАТОРЫ
Составными частями сложных фиксаторов являются простые. Существует множество вариантов фиксирующих смесей. Ниже приведены наиболее распространенные.
Спирт-формол по Шафферу — 10 % нейтральный формалин, который готовят из 1 части нейтрального 40 % формалина и 2 — 3 частей 96 % спирта.
Продолжительность фиксации 24-48 ч. Дальнейшая промывка в воде не требуется, и материал сразу же помещают в 96 % спирт.
Солевой формол
Нейтральный 40 % формалин 100 мл
Хлорид натрия 8,5 г
Водопроводная вода 900 мл
Продолжительность фиксации 48 ч при 20 °С с последующей промывкой в проточной воде в течение 6-12 ч.
Жидкость Буэна — классический фиксатор для экспериментальных исследований.
Насыщенный раствор пикриновой кислоты 75 мл
Нейтральный 40 % формалин 25 мл
Ледяная уксусная кислота 5 мл
Продолжительность фиксации 1-24 ч при 20 °С.
Насыщенный раствор пикриновой кислоты готовят заранее из расчета 3г кристаллической пикриновой кислоты на 1л горячей дистиллированной воды. После фиксации кусочки отмывают от избытка пикриновой кислоты в 70 % спирте, затем заливают в парафин.
Кальций-формол по Бейкеру используют для фиксации липидов.
А. 10 мл 40 % формалина + 90 мл дистиллированной воды.
Б. 1 г хлорида кальция.
Растворы А и Б смешивают.
Продолжительность фиксации 24-48 ч при 20 °С.
Жидкость Карнуа — универсальный фиксатор для большинства гистологических и гистохимических исследований (кроме выявления липидов).
Спирт 100 % или 96 % 60 мл
Хлороформ 30 мл
Ледяная уксусная кислота 10 мл
Продолжительность фиксации 2-4 ч при 4 °С или 1-2 ч при 20 °С. Затем материал помещают в 100 % спирт. Если материал не сразу подлежит проводке, то его можно перенести в 96 % спирт и держать в нем до 3 сут.
Используется также фиксатор Карнуа I, в состав которого входят 75 мл 100 % спирта и 25 мл ледяной уксусной кислоты. Условия фиксации те же.
В случае отсутствия этилового спирта вместо жидкости Карнуа можно использовать смесь следующего состава.
Изопропиловый спирт 60 мл
Пропионовая кислота 30 мл
Ацетон 10 мл
Диоксан 10 мл.
Продолжительность фиксации 12-24 ч при 20 °С; для промывки и обезвоживания применяют изопропиловый спирт.
ПРАВИЛА РАБОТЫ С ФИКСАТОРАМИ
Практически все фиксаторы относятся к токсичным веществам (альдегиды, ацетоны, спирты), некоторые ядовиты (сулема, тетраоксид осмия, метанол), поэтому необходимо соблюдать правила техники безопасности при работе с реактивами, которые используют в гистологической практике.
Фиксацию и вырезку материала необходимо производить в вытяжном шкафу. Материал, извлеченный из фиксатора, содержащего формалин, желательно в течение нескольких минут промыть в проточной воде, так как пары формалина оказывают раздражающее действие на слизистые оболочки глаз и органов дыхания.
ВОЗМОЖНЫЕ АРТЕФАКТЫ, СВЯЗАННЫЕ С ФИКСАЦИЕЙ,
И ИХ УСТРАНЕНИЕ
При фиксации формалином, особенно кислым, возможно появление в срезах темно-коричневого пигмента в виде зернышек или глыбок (результат реакции формалина с гемоглобином ткани). Пигмент удаляют, помещая срезы на 15-20 мин в 1-5 % раствор аммиака или 70 % спирт. После промывания водой препарат можно окрашивать. Хорошо удаляется пигмент в растворе 1 % гидроксида калия в 80 % спирте (1:25): после 10-минутной экспозиции препарат промывают в проточной воде в течение 5 мин.
В случаях значительного уплотнения ткани в результате слишком продолжительной фиксации кусочки помещают на 1-2 ч в 10 % раствор лимонной кислоты (материал становится более мягким и пригодным для исследования).
Кристаллический осадок, образующийся после фиксации с применением сулемы, удаляют из кусочков или лучше срезов с помощью йодированного 70 % спирта.
Гистолог при исследовании микропрепаратов должен учитывать ряд возможных артефактов, вызванных фиксацией материала:
1. развитие в тканях аутолиза при крупных размерах объектов или плохой их фиксации, при этом оценка срезов ограничена (нельзя высказаться достоверно о степени выраженности отёка тканей, степени выраженности дистрофических изменений клеток, клеточной реакции, т.к. на фоне аутолиза клеточные элементы распадаются),
2. сжатие тканей при их фиксации (может доходить до 40% от первоначального объёма), а также набухание тканей при фиксации приводят к артефактам при микроморфометрии (например, увеличение количества лейкоцитов в поле зрения микроскопа при фиксации объекта мягких тканей 72 часа и более по сравнению с этим же кусочком мягких тканей, фиксированным 24-48 часов),
3. механическая травма нервной ткани при вскрытии черепа, исследовании головного мозга — сморщивание, гиперхромия ядер нейронов, их деформация,
4. постоянный артефакт в ЦНС — периваскулярные и перицеллюлярные щели, ошибочно диагностируемые как периваскулярный и перицеллюлярный отёк и др.
Проиллюстрируем вышеописанное:
|
Рис. 1, 2. Мягкие ткани головы с распространённым крупноочаговым деструктивным кровоизлиянием буровато-тёмно-красного цвета, с преобладающим гемолизом эритроцитов, признаками организации, на фоне формалиновой пигментации. Гематоксилин-эозин. Увеличение х250. |
|
|
Рис. 3. Фрагмент контакта твёрдой мозговой оболочки головного мозга и подострой субдуральной гематомы на фоне формалиновой пигментации. Гематоксилин-эозин. Увеличение х250. |
|
|
|
|
|
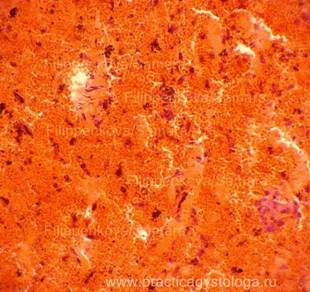
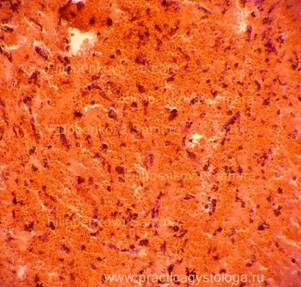
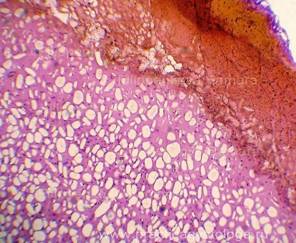
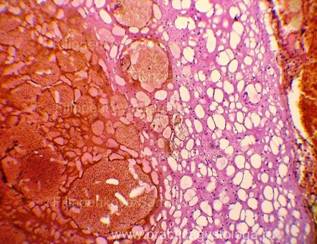
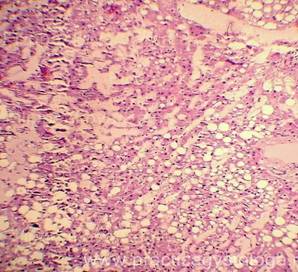
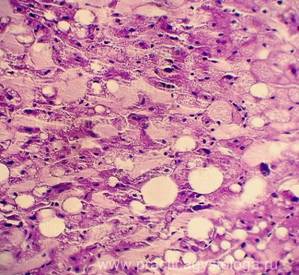
Рис. 4, 5. Очаги гнилостной эмфиземы в ткани печени, выраженный аутолиз. Гематоксилин-эозин. Увеличение х100 и х250. |
|
|
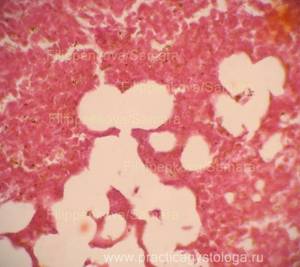
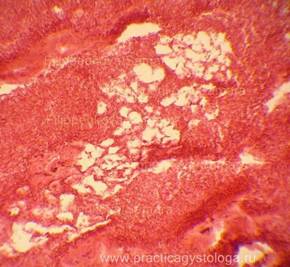
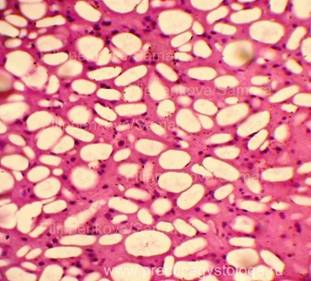
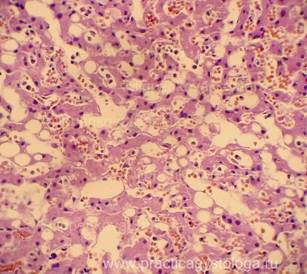
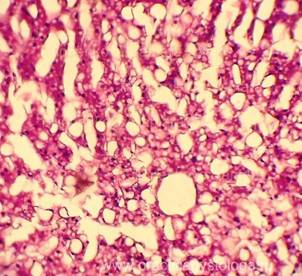
Рис. 6, 7. Очаги гнилостной эмфиземы в ткани почки, выраженный аутолиз. Гематоксилин-эозин. Увеличение х100. |
|
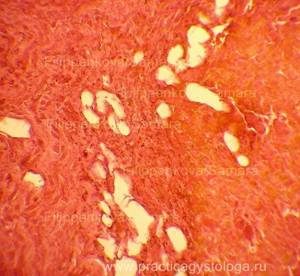
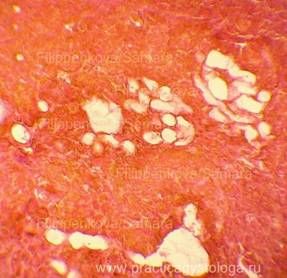
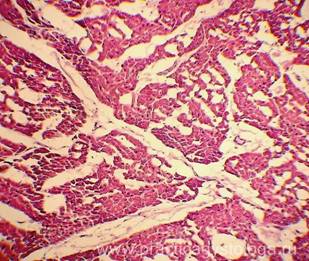
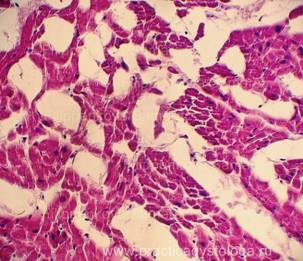
Гистологические признаки посмертного промерзания тканей трупа.
При посмертном промерзании тканей под микроскопом в них видны игольчатые или ячеистые округло-овальные дефекты (следы разрывов от растаявших льдинок). При таком состоянии тканей достоверно высказаться об их кровенаполнении, наличии и степени выраженности отёка, ряда патологических состояний не представляется возможным.
|
Рис. 1, 2. Признаки посмертного промерзания в миокарде в виде густо расположенных ячеистых округло-овальных дефектов-пустот, на фоне умеренно выраженных аутолитических изменений. Гематоксилин-эозин, увеличение х100 и х250. |
|
|
Рис. 3-5. Признаки посмертного промерзания в веществе коры-подкорковой области головного мозга в виде густо расположенных ячеистых округло-овальных дефектов-пустот, на фоне ЧМТ (массивные деструктивные кровоизлияния под ММО и в веществе мозга), умеренно выраженных аутолитических изменений. Гематоксилин-эозин, увеличение х100х и х250. |
|
Рис. 6-9. Признаки посмертного промерзания в ткани печени в виде густо расположенных ячеистых округло-овальных дефектов-пустот, на фоне умеренно выраженных аутолитических изменений, различима жировая дистрофия ряда гепатоцитов. Гематоксилин-эозин, увеличение х250. |
|